タンニンのタンパク質凝集メカニズムの解明に成功
~タンパク質の凝集の関与する生命現象や生理活性分子の活性メカニズムの解明に期待~
2025年8月1日
岐阜大学
タンニンのタンパク質凝集メカニズムの解明に成功 ~タンパク質の凝集の関与する生命現象や生理活性分子の活性メカニズムの解明に期待~
本研究のポイント
・複数分子同時分子動力学シミュレーションによりタンニンのタンパク質凝集過程の再現に成功しました。
・NMR法を用いた実験結果は、このシミュレーション結果を支持しました。
・本方法は、タンパク質の凝集を通じて生物活性を示す化合物の機構の解明に寄与することが期待されます。
・さらに本方法は、より広範囲のタンパク質の凝集の関与する生命現象解明に寄与することが期待されます。
研究概要
岐阜大学応用生物科学部山内恒生准教授らの研究グループは複数分子同時分子動力学シミュレーションによりタンニンのタンパク質凝集過程の再現に成功しました。
天然由来の生物活性分子の中には、タンパク質の特定の位置に結合することで活性を制御する化合物と、タンパク質の様々な場所に結合し凝集を生じることにより活性を示す化合物が存在します。特定の位置に結合する化合物はすでに、結合箇所を明らかにする方法により、相互作用の分子メカニズムが解明されてきました。一方で、凝集を生じることで活性を示す化合物とタンパク質の相互作用は、複雑で、分子レベルでどのように相互作用しているかを明らかにすることができませんでした。タンニン注1)は、代表的なポリフェノールのひとつであり、タンパク質の凝集により生物活性を示す天然由来分子の代表的な化合物です。このため世界中の研究者がタンニンのタンパク質相互作用様式の解明を試みてきましたが、実際の溶液中で3次元構造をもつタンパク質との相互作用様式は明らかにされていませんでした。本研究では、代表的な加水分解性タンニンであるトリガロイルグルコース(TGG)とコラーゲン分解酵素であるmatrix metalloproteinase-1(MMP-1) 注2)の凝集過程を分子動力学(MD)シミュレーション注3)により可視化することに成功しました。さらに、MDシミュレーション結果と、HSQC NMR法注4)による実験的なデータは一致することがわかりました。これは、MDシミュレーションによるTGGとタンパク質の凝集過程の可視化が信頼できることを示すものであり、さらに本方法がタンパク質の凝集を生じることにより活性を示す化合物の作用様式を解明する方法として有用であることが示すものです。今後、同様の方法は、これまで明らかにできなかったタンパク質の凝集の関与する生命現象解明に寄与することが期待されます。
本研究成果は、現地時間2025年7月25日に英国の国際誌であるFood Chemistry誌のオンライン版で発表されました。
研究背景
タンパク質の凝集は、様々な生命現象に関与しています。例えば、認知症やパーキンソン病、プリオン病、ALS(筋萎縮性側索硬化症)、白内障など多くの病気がタンパク質凝集により生じています。また、ペプチドやアルカロイド、ポリフェノールなどタンパク質と凝集を通じて生物活性を示す化合物も多く存在します。タンニンはタンパク質と凝集を示す代表的な化合物です。タンニンは抗癌活性や抗炎症活性、血糖値低下作用、抗酸化活性等ありとあらゆる薬理作用を持つ植物成分として知られています。また、タンパク質と結合する性質から、飲料水の濁り取りや、皮を柔らかくする作用、天然の接着剤としての利用も期待されています。お茶やワインの渋み成分としても良く知られており、食品の味にも深くかかわっています。この様に、タンパク質の凝集は様々な重要な生物活性や生命現象に関わっているにもかかわらず、その相互作用が複雑で、分子レベルで作用機構を解き明かすことは不可能とされていました。また、それを調べる方法でさえも確立されておらず、これを明らかにすることが長年研究者によって試みられてきました。凝集を分子レベルで理解することができれば、多くの化合物の利用の幅が広がり、様々な生命現象の理解に繋がります。本研究は、タンパク質と凝集を示す代表分子であるタンニンを用いて、タンパク質との相互作用及び、どのようにして凝集が生じるのかを分子レベルで初めて明らかにしました。
本研究では当研究グループで、これまで実施してきたNMR法を用い、タンパク質とタンニンの結合部位を特定しました。さらに、ここに新たにMDシミュレーションの結果を合わせて考察することにしました。NMR法では、タンパク質と分子の一対一の結合だけでなく、一対多数の結合箇所を明らかにすることが可能となります。また、液体中のタンパク質と化合物の相互作用の測定であるため、より実際に近い結合を測定することが出来ます。これらの特徴はタンニンとタンパク質の相互作用を明らかにするために、とても良い方法であると考え、以前から関連研究に取り入れています。
研究成果
代表的な加水分解性タンニンであるTGG (図1C) 、ペンタガロイルグルコース (PGG)、Corilagin及びその部分構造であるガリック酸とコラーゲン分解酵素であるMMP-1の相互作用部位をHSQC NMR法で調査しました。MMP-1のNMRシグナルがタンニンと混合することにより変化する箇所を図1Aのように色づけました。TGG(図1C)の濃度が濃くなるにしたがって、色のついた結合個所が多く、広くなっていることがわかります。また、その変化量は図に示すように86番目のグルタミン(Q86)で最も大きいことがわかります(図1B)。
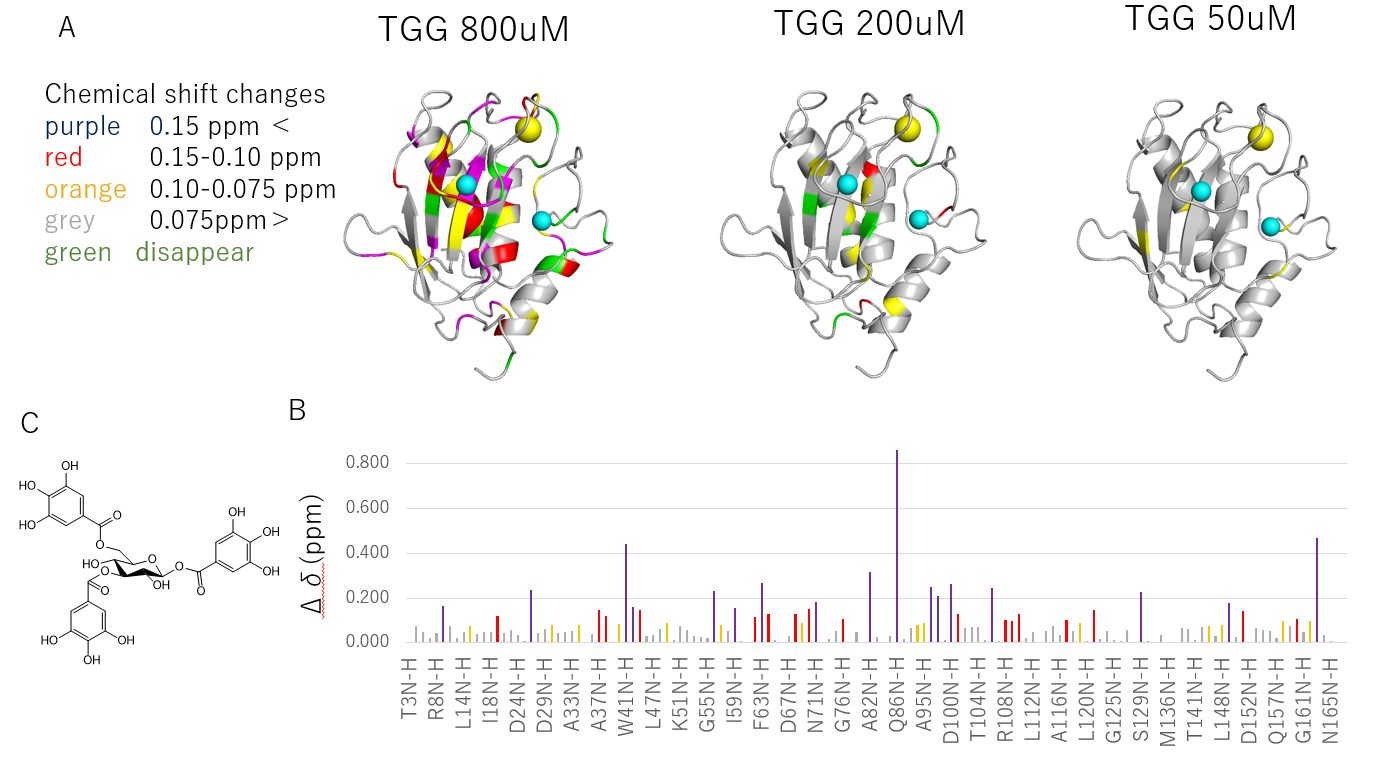
図1 NMR法で示された加水分解性タンニンのタンパク質結合箇所
A: TGGの各濃度を作用させたときのNMRシグナル(ケミカルシフト)が変化した箇所を色付けた。タンパク質の色のついたところがタンニンと結合している可能性が高い
B: 各アミノ酸残基のNMRケミカルシフトの変化量
C: TGGの構造
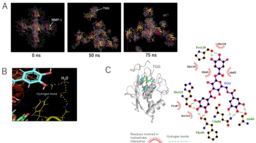
加えて、MDシミュレーションでタンニンとタンパク質の相互作用様式を調査しました。MDシミュレーションは連続して分子にかかる力及び運動を計算することで、分子の動きを可視化することができるシミュレーションです。これまで、タンパク質1分子に対して、タンニン1分子のシミュレーションしか行われていませんでしたが、実際の分子運動は複数のタンパク質に複数のタンニンが相互作用します。このため、実際の結合をシミュレーションできていませんでした。本研究は、TGGがMMP-1 の活性を阻害する比率であるTGG:MMP-1=13 : 1の比で分子を空間上にランダムに配置し、水分子やイオンを入れた実際の状況に近い条件でMDシミュレーションを行いました。
その結果、図2Aに示すようにMMP-1同士はTGGを介して架橋し、凝集する過程がシミュレーションされました。
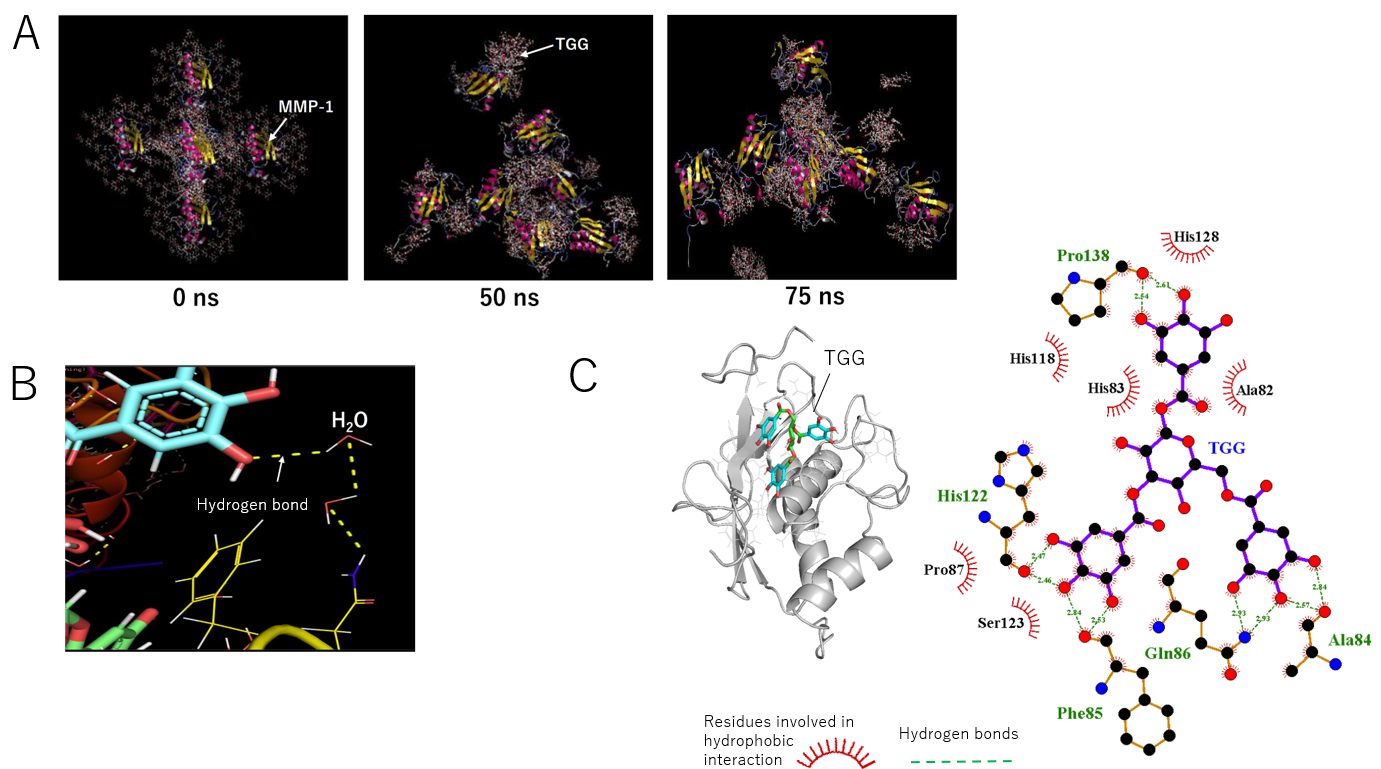
図2 タンニンとタンパク質のMDシミュレーション(A、B)とドッキングシミュレーション(C)の結果
図2CはTGGとMMP-1のドッキングシミュレーション注5)の結果です。ドッキングシミュレーションは結合エネルギーの計算により、タンパク質と結合する化合物の位置や結合力を推測することが出来る方法です。タンニンのフェノール性水酸基とタンパク質が水素結合により相互作用していることがわかります。また、MDシミュレーションでもタンニンの水酸基がタンパク質と相互作用していることが明らかになりました。特に、MDシミュレーションの場合、水分子も含めてシミュレーションをしているため、水分子を介した相互作用も確認されました。総合的に、直接タンニンとタンパク質が水素結合して相互作用している数よりも、水分子を介して相互作用している方が多いことも明らかとなりました。タンニンは直接タンパク質と結合していると考えられていたため、この結果は今までの通説を覆すものです。
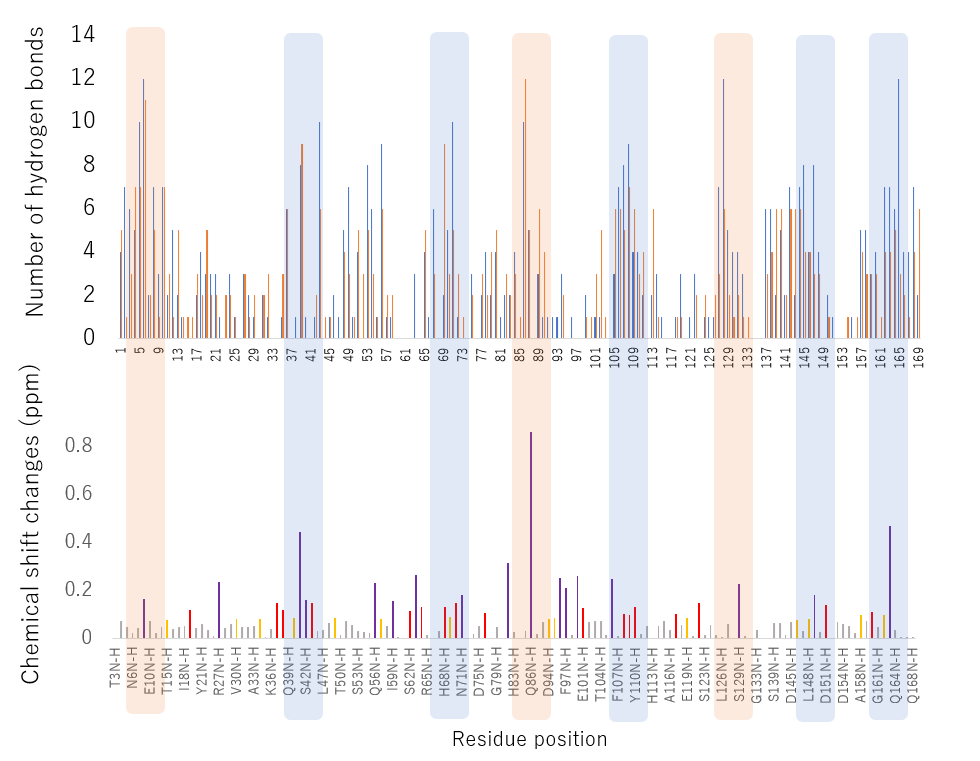
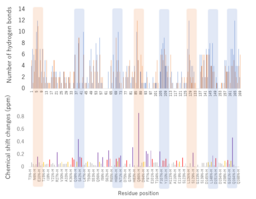
図3 NMR法で示された結合個所(下)とMDシミュレーションで示されたMMP-1の部位ごとの水素結合の数(上)
ハイライトした部分は、MDシミュレーションとNMR法の結果が一致した部分。オレンジでハイライトした部分は、距離的に86番目のGlnに近い部位。
MDシミュレーションで示されたタンニンとタンパク質の水素結合の数をタンパク質の各部位にプロットしました。さらにMMP-1のNMRシグナルがタンニンにより変化した箇所と比較しました。その結果、両者が示す結合の箇所が良い一致を示しました(図3)。MDシミュレーションだけでなく、NMRによる実際に結合させたデータに共通性が見られたことにより、MDシミュレーションによる凝集過程の信頼性が増したと言えます。
以上の結果から、初めてタンニンのタンパク質凝集過程を可視化することに成功し、両者の結合位置の特定に結びつきました。
今後の展開
今回の研究で、加水分解性タンニンとMMP-1の相互作用様式が明らかになりました。しかし、タンニンのタンパク質凝集機構を明らかにしたのは今回の一例のみです。その他の別のタンパク質との相互作用や、他のタンニンにおける相互作用に関しては未だに明らかになっていません。MMP-1とTGGの相互作用が特殊な事例の可能性も考えられます。そのため、より多くの種類のタンパク質で、様々なタンニンを用いて同様に相互作用を解析することで、より一般的なタンニンとタンパク質の相互作用を明らかにすることができます。これにより、タンニンの生物活性の増強や、渋みの調節、工業利用の幅が広がることが考えられます。さらに、タンパク質凝集の分子メカニズムを調査する方法として、本方法が確立されることで、タンニン以外の凝集を示す分子の相互作用や、タンパク質凝集により生じる認知症やパーキンソン病などの疾病の分子メカニズム解明、及びその治療薬の開発にも役に立つことが期待されます。
論文情報
雑誌名:Food Chemistry
タイトル:Protein-tannins binding mode in hydrolysable tannins-induced protein aggregation
著者:Mana Yoshimura, Yoshiki Sugahara, Kana Nagase, Miho Kobayashi, Yuji O. Kamatari, Kosei Yamauchi*
DOI:10.1016/j.foodchem.2025.145672
論文公開URL:https://doi.org/10.1016/j.foodchem.2025.145672
用語解説
注1)タンニン:
植物中に広く分布するポリフェノールの一種。加水分解性タンニンと縮合型タンニンに大別される。縮合型タンニンはカテキン類が重合した構造をもち、タンパク質との強い相互作用を示す。
注2)MMP-1:
コラーゲン分解酵素のひとつ。コラーゲンを分解することで癌細胞の転移や、しわの原因となることが知られている。
注3)MDシミュレーション:
連続して分子にかかる力及び運動を計算することで、分子の動きを可視化することができるシミュレーション。
注4)核磁気共鳴分光 (NMR):
化合物に磁場を与えることにより、その構造を測定する方法。低分子化合物やタンパク質などありとあらゆる分子の構造解析に用いられている。
注5)ドッキングシミュレーション:
コンピューター上でのエネルギー計算により、タンパク質と結合する化合物の位置や結合力を推測することが出来る方法。
研究者プロフィール
吉村 真菜(よしむら まな): 筆頭著者
岐阜大学大学院 自然科学技術研究科 修士1年 学生
菅原 由喜(すがはら よしき)
岐阜大学 応用生物科学部 2022年度卒業
長瀬 華奈(ながせ かな)
岐阜大学 応用生物科学部 2023年度卒業
小林 美穂(こばやし みほ)
岐阜大学 糖鎖生命コア研究所 技術補佐員
鎌足 雄司(かまたり ゆうじ)
岐阜大学 糖鎖生命コア研究所 助教
山内 恒生(やまうち こうせい):論文責任著者
岐阜大学 応用生物科学部 准教授
本プレスリリースは発表元が入力した原稿をそのまま掲載しております。また、プレスリリースへのお問い合わせは発表元に直接お願いいたします。
このプレスリリースには、報道機関向けの情報があります。
プレス会員登録を行うと、広報担当者の連絡先や、イベント・記者会見の情報など、報道機関だけに公開する情報が閲覧できるようになります。
このプレスリリースを配信した企業・団体

- 名称 国立大学法人東海国立大学機構岐阜大学
- 所在地 岐阜県
- 業種 大学
- URL https://www.gifu-u.ac.jp/
過去に配信したプレスリリース
糖鎖合成酵素 B4GALNT3 のレクチンドメインを発見
3/3 10:00
量子センシング技術を活用した生体内における複数のアミノペプチダーゼ活性の同時検出
2/27 09:00
妊娠に必須であるマクロファージを同定
2/25 10:00
前がん病変の遺伝子発現で肝発がんのリスクを予測
2/24 14:00
ダイアベティス(糖尿病)治療薬DPP-4阻害薬の“真の主役”はGIPだった!?
2/17 14:00
難治性乳がんの治療を目指す新たな候補化合物を創出
2/13 14:00
早朝食欲促進による高齢フレイル改善法を発見
2/12 10:00
卵巣癌の急速な腹膜播種形成のメカニズムを発見!
2/9 09:00
低分子コアセルベートの内部構造を分子レベルで解明
2/4 14:00
炎症やCOPDなどに関わる糖鎖の新たな制御機構
2/2 11:00
ダイアベティス(糖尿病)に伴う筋肉の衰えを防ぐ仕組みを解明
1/30 14:00
再侵入を許さない!沖縄県久米島におけるアリモドキゾウムシの迅速な根絶事例
1/30 10:00