がんのサポート役を狙い撃ち-3Dミクロ腫瘍で見えた新たながん治療標的
2025年10月9日
早稲田大学
がんのサポート役を狙い撃ち 3Dミクロ腫瘍で見えた新たながん治療標的
詳細は早稲田大学ホームページをご確認ください。
| <発表のポイント> ・体内に近い立体的ながん組織(3Dミクロ腫瘍)を使った創薬スクリーニングにより、従来の方法では見逃されていた、がん細胞のまわりにある「サポート役」の細胞の働きを弱める薬を多数発見しました。 ・「ドラマピモド」という薬が、サポート役の細胞の一つである腫瘍随伴線維芽細胞の働きを抑制することでがん増殖を抑え、既存の抗がん剤や免疫治療薬との併用効果を高めました。 ・3Dミクロ腫瘍を用いた創薬スクリーニングは、がん細胞の「サポート役」の細胞を狙い撃つことで治療効果を上げる、新しいタイプのがん治療法の開発につながると期待されます。 |
がん治療といえば、現在はがん細胞そのものを狙う薬が中心ですが、実はがんの周囲にいるがんを“サポート”する細胞も、がんの進行や転移、悪性化を助ける大事な要素です。
早稲田大学高等研究所の西田奈央(にしだなお)講師は、米国フレッド・ハッチンソンがん研究センターの研究チームとともに、実際の患者体内の腫瘍に近い「3Dミクロ腫瘍モデル※1」を使って創薬スクリーニングを行い、従来の創薬スクリーニング手法では見逃されていた、がんの「サポート役」の細胞に効く薬を多数発見しました。
その中で「ドラマピモド(doramapimod)※2」という、本来抗炎症薬候補として開発された化合物が、がんの周囲にあるサポート役の細胞の一つである腫瘍随伴線維芽細胞(cancer-associated fibroblast, CAF)※3の働きを弱めることで、がん増殖を抑制し抗がん剤や免疫治療薬の効果を高めることがわかりました。
本研究で用いた手法は、がんの「サポート役」の細胞を標的とする新しい治療法の開発につながる成果です。
本研究成果は2025年9月19日に国際学術誌Cell Reports Medicine(オンライン版)に先行公開され、10月号に出版されます。
(1)これまでの研究で分かっていたこと
がんは現在も日本人の死因の第1位であり、より効果的な治療法の開発が強く求められています。これまでのがん治療は、がん細胞そのものを直接攻撃する薬の開発が中心でした。そのため、創薬開発時は、がん細胞のみを純粋に培養皿で育てる「2次元培養」で候補化合物を絞り込んできていました。
しかし近年、がんのまわりにいる細胞(血管細胞、免疫細胞、線維芽細胞など)が、がんの増殖や転移、悪性化を「サポート」していることが明らかになってきました。実際に、血管新生阻害剤や免疫チェックポイント阻害剤など、がんの「サポート役」の細胞を標的とした薬も実用化されています。
そのため、がん細胞と周囲の細胞を一体として捉えた、より現実に近い新しい創薬モデルの必要性が高まっていました。
(2)今回の研究で明らかになったこと
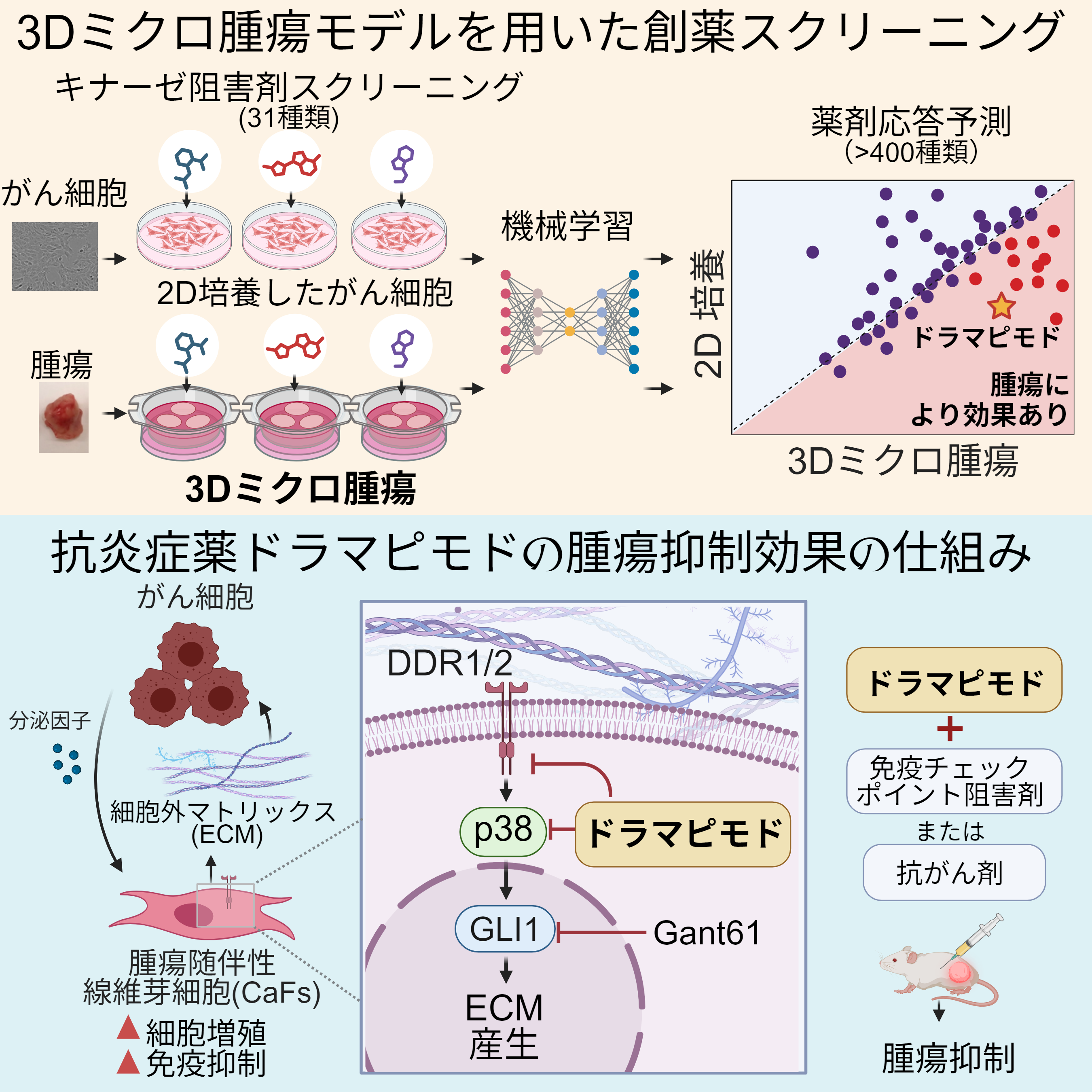
今回、早稲田大学高等研究所の西田奈央講師と米国Fred Hutchinson Cancer Centerの研究チームは、実際の腫瘍に近い“3Dミクロ腫瘍モデル”を用いて、機械学習と組み合わせた新たな薬剤スクリーニング手法を開発しました。マウスの乳がんや膵がんモデルを用いて、400種類以上の薬剤をスクリーニングしたところ、「ドラマピモド」という、がん細胞を直接攻撃するのではなく、がん細胞をサポートする腫瘍随伴線維芽細胞を標的とする薬剤を見出しました。このドラマピモドの作用機構を調べる過程で、細胞外マトリックスを生産する経路として、新たに非古典的ヘッジホッグ経路「DDR1/2–MAPK12–GLI1」を見出しました。
研究チームは、マウス由来の乳がんおよび膵がん組織から作製した3Dミクロ腫瘍モデルに対して、31種類のキナーゼ※4阻害剤という、細胞内のシグナル伝達を担うタンパク質を標的とする薬剤の効果を調べました。この実験結果と既知のキナーゼ阻害剤の効果を併せて機械学習を用いて、全て実験的に試験することなく、400種類以上のキナーゼ阻害剤に対する応答を予測しました。同様の試験を同じがん細胞を実験室で平面培養した場合でも実施して、阻害剤の効果を調べました。
薬剤スクリーニングにおいて3Dミクロ腫瘍モデルに対して有効だとして見出された薬剤は、一般的に用いられている2次元がん培養細胞に有効な薬剤の数と比較して、3倍以上でした。この結果は、これまでの手法では見逃されていた薬剤が多数あることを示唆しています。この3Dミクロ腫瘍モデルは、腫瘍を生きたままミクロサイズに切って実験室で維持したもので、もともとの腫瘍組織の構造や内部のがん細胞と周辺細胞の組成を維持しており、広く実験や創薬スクリーニングで用いられている、がん細胞のみを純粋にプレート上で2次元培養したモデルと比べて、体内により近い状態で薬の効果を評価できます。研究者らは、マウス乳がんおよび膵がんの3Dおよび2Dモデルに対して、新薬候補として開発されたキナーゼ阻害剤のスクリーニングを行い、機械学習を活用して実験効率を高めました。
3Dミクロ腫瘍モデルに効果が高い薬剤の中でも、特に「ドラマピモド」というp38阻害剤に着目しました。もともとリウマチなどの炎症性疾患の治療薬として開発されたドラマピモドは、がん細胞の生存や増殖には直接影響を及ぼしませんでしたが、腫瘍随伴線維芽細胞の機能を阻害することで、腫瘍の増殖抑制効果を示しました。ドラマピモドは、CAF内のDDR1/2というコラーゲン受容体、および下流のMAPK12というタンパク質を阻害し、CAFによる細胞外マトリックス(ECM)※5(コラーゲンなど、がん細胞のまわりに広がる足場構造)の産生や、炎症を促す因子の産生を抑制しました。結果として、免疫細胞(特にCD8陽性T細胞)のがん組織への浸潤が促進され、現在臨床で用いられる抗がん剤gemcitabineや免疫チェックポイント阻害剤との併用で高い治療効果が得られました。また、この腫瘍抑制効果は、実際の患者由来の腫瘍スライスや複数のマウスがん移植モデルでも確認できました。
さらに今回、DDR1/2–MAPK12経路が、CAF内の転写因子GLI1※6を活性化し、ECM産生を誘導していることを明らかにしました。これまでGLI1は、主に「ヘッジホッグ経路(SHH-SMO)※7」により活性化されることが知られていましたが、今回の知見は、DDR1/2-MAPK12経路がGLI1を活性化する「非古典的(non-canonical)」な経路であることを示しています。さらに、GLI1阻害剤の投与によっても同様にCAF機能の抑制が起こり、腫瘍抑制効果があることを確認しました。
(3)研究の波及効果や社会的影響
本研究で確立した3Dミクロ腫瘍モデルを用いた創薬スクリーニングは、がんの「サポート役」の細胞を狙い撃つ新たながん治療薬開発を加速させる基盤技術だと言えます。今回の研究では、3Dミクロ腫瘍を用いることで、腫瘍随伴線維芽細胞(CAF)を狙い撃つ薬剤ドラマピモドを見出すことができました。このような薬剤は、従来のがん細胞のみを2次元培養した創薬スクリーニングではこれまで見逃されてきたものです。実際に、今回のスクリーニングでは、3D腫瘍モデルに対しては従来の2Dモデルに比較して3倍もの治療薬候補が見出されました。がんの「サポート役」の細胞の重要性が強まっている中、本システムは新たな創薬プラットフォームとして期待が高まります。
さらに、この薬剤スクリーニング手法は、患者さんから手術で摘出した腫瘍を用いても同様に実施可能であり、個別化医療(precision medicine)※8へ応用できる可能性があります。がん治療に用いることのできる複数の治療薬の中から、まず、手術検体から作製した3D腫瘍モデルで治療効果を検証し、患者さんごとに最も有効な薬剤を選んで投与することができると期待しています。
今回特定したドラマピモドは、特に、膵臓がんをはじめとする細胞外マトリックス(ECM)が多く線維化が強い腫瘍(desmoplastic tumors)※9に対する有効性が見込まれます。線維化した腫瘍では薬剤が腫瘍内部まで到達しにくく治療効果が得られにくいですが、ドラマピモドで線維化を低下させることで薬剤の到達性を高め、さらに免疫反応を促進することで治療効果を向上できると見込んでいます。
また、今回ドラマピモドの作用機序を研究する過程で、CAF内において非古典的ヘッジホッグ経路(DDR1/2–MAPK12–GLI1)によるECM産生制御が新たに明らかになりました。GLI1を活性化する新たなシグナル経路が見つかったことで、過去に膵臓がん患者を対象に臨床開発が行われた古典的なヘッジホッグ経路の阻害薬の腫瘍抑制効果が不十分だった理由が説明できます。今後は、DDR1/2やGLI1などを標的とする薬剤との併用により、CAFによるECM産生機能を抑制し、腫瘍抑制効果を改善する治療戦略に使うことも考えられます。
(4)課題、今後の展望
本研究では、ドラマピモドやGLI1阻害剤など、がん細胞の周囲にいる“サポート細胞”を標的とする薬剤を同定しましたが、今回得られた成果をすぐに臨床へ応用できるわけではありません。ドラマピモドは、もともと自己免疫疾患を対象に臨床開発された化合物ですが、臨床開発の過程で肝毒性により中止された経緯があります。また、ドラマピモドやGLI1阻害剤は、本来標的としたタンパク質以外のタンパク質にも一部阻害効果があるため、予期しない副作用が生じる懸念があります。そのため、肝毒性の軽減と、DDR1/2–MAPK12–GLI1経路をより選択的かつ安全に抑える新たな薬剤(類縁体)の開発が不可欠です。また、ドラマピモドが標的とするコラーゲンなどのECMは、正常な繊維芽細胞により産生されて、すべての正常組織にも存在し、組織の維持や修復に重要な役割を果たしています。そのため、阻害効果を腫瘍組織やCAFだけに限定することが今後の大きな課題です。
(5)研究者のコメント
がん細胞は、他の細胞の様々な細胞との関係性の中で生存しています。今回は、がんを直接攻撃するのではなく、その「サポート役」を狙う治療薬をスクリーニングする方法論を提示しました。がん細胞だけではなくて、その「サポート役」の細胞を標的とする治療薬も用いることで、より治療効果を上げることができると考えています。今回は乳がんと膵がんを対象に実験をしましたが、別のがんに応用するとまた新しい薬剤が見出されると期待しています。
(6)用語解説
※1 3Dミクロ腫瘍モデル
生体から取り出した腫瘍をミクロサイズに切り分け、腫瘍内の細胞構造や微小環境を保持したまま実験室で培養できるモデル。体内の腫瘍に近い状態で薬剤効果を評価できる。
※2 ドラマピモド(Doramapimod)
もともと自己免疫疾患や炎症性疾患の治療薬として開発されたMAPK阻害薬。今回、CAFを標的として抗がん作用を示すことが明らかになった。
※3 腫瘍随伴線維芽細胞(CAF: Cancer-Associated Fibroblasts)
がん細胞の周囲に存在し、コラーゲンなどを産生して腫瘍を支える「サポート役」の細胞。がんの成長や転移を助けると同時に、薬剤が届きにくくなる原因ともなる。
※4 キナーゼ
細胞内のタンパク質にリン酸を付けることで、細胞内のシグナル伝達を担う酵素。細胞の増殖や分化など、生命活動を制御する中心的な役割を担う。
※5 細胞外マトリックス(ECM: Extracellular Matrix)
コラーゲンなど、細胞の外側を取り囲む構造体。腫瘍で増加すると“線維化”を引き起こし、薬剤の浸透を妨げる。
※6 GLI1
ヘッジホッグ経路の下流にある転写因子。CAFで活性化するとECM産生を促進し、腫瘍進展に寄与する。
※7 ヘッジホッグ経路(Hedgehog signaling pathway)
細胞の分化や発生を制御するシグナル伝達経路。がんで異常活性化すると腫瘍進展に関与する。
古典的経路:SHH–SMOを介してGLI1を活性化するルート。
非古典的経路:古典的経路以外の活性化経路。
※8 個別化医療(Precision Medicine)
患者ごとの腫瘍を使って薬剤効果を事前に評価し、その患者に最も有効な薬を選んで投与する医療アプローチ。
※9 線維化腫瘍(desmoplastic tumors)
腫瘍組織で線維成分が異常に増え、硬くなる状態。膵臓がんに典型的で、治療薬の到達を阻害し治療を難しくする。
(7)論文情報
雑誌名:Cell Reports Medicine
論文名:Drug Screening in 3D Microtumors Reveals DDR1/2-MAPK12-GLI1 as a Vulnerability in Cancer-Associated Fibroblasts
執筆者名(所属機関名):西田奈央(にしだなお)(早稲田大学)、Songli Zhu(Fred Hutchinson Cancer Center)、Marina Chan(Fred Hutchinson Cancer Center)、Yuqi Kang(Fred Hutchinson Cancer Center)、Maihi Fujita (University of Utah)、Xiuyun Jiang(Univeristy of Washington)、Maxwell McCabe(University of Colorado)、Joel M. Vaz(Fred Hutchinson Cancer Center)、Nancy E. Davidson(Fred Hutchinson Cancer Center)、Cyrus M. Ghajar(Fred Hutchinson Cancer Center)、Kirk Hansen(University of Colorado)、Alana L. Welm(University of Utah)、Vanu G. Pillarisetty (University of Washington)、Taranjit S. Gujral (Fred Hutchinson Cancer Center)
掲載⽇時(⽇本時間): 2025年9月19日(online first)
掲載URL: https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(25)00430-6
DOI: https://doi.org/10.1016/j.xcrm.2025.102357
(8)キーワード
がん、腫瘍、がん治療、創薬スクリーニング、腫瘍微小環境、腫瘍随伴線維芽細胞(Cancer associated fibroblast, CAF)、細胞外マトリックス (Extracellular matrix, ECM)、抗がん剤、3D腫瘍モデル、キナーゼ、個別化医療 (precision medicine)、非古典的ヘッジホッグ経路(non-canonical hedgehog pathway)
(9)研究助成(外部資金による助成を受けた研究実施の場合)
National Cancer Institute (R01CA273081 and R01-CA272677)、
Cancer Center Support Grant (NCI 5 P30 CA015704-49)、
Breast Cancer Research Foundation (BCRF 17-035)、
Washington Research Foundation、
the Fred Hutch Interdisciplinary Training Grant Dual Mentor Fellowship in Cancer Research、
JSPS overseas research fellowship(日本学術振興会 海外特別研究員制度)、
the Comparative Medicine, Cellular Imaging, and Experimental Histopathology Shared Resources of the Fred Hutch/University of Washington Cancer/Seattle Children’s Cancer Consortium (P30 CA015704)
本プレスリリースは発表元が入力した原稿をそのまま掲載しております。また、プレスリリースへのお問い合わせは発表元に直接お願いいたします。
このプレスリリースには、報道機関向けの情報があります。
プレス会員登録を行うと、広報担当者の連絡先や、イベント・記者会見の情報など、報道機関だけに公開する情報が閲覧できるようになります。
このプレスリリースを配信した企業・団体

- 名称 早稲田大学
- 所在地 東京都
- 業種 大学
- URL https://www.waseda.jp/top/
過去に配信したプレスリリース
早稲田大学WASEDA NEO「早稲田公共政策カレッジ」が教育訓練給付制度認定
2/18 17:30
学生は何を基準に就職先を選ぶのか?
2/16 10:00
分子の「長さ」で光の性質を自在に制御
1/30 11:00
YbN 合金化により AlN 薄膜の熱伝導を大幅抑制
1/28 14:00
高い幸福感が全死因死亡リスクの低下に関連
1/28 13:00
体温で自動的に展開する血管ステントを開発
1/22 13:00
蛇紋岩は「非地震性すべり」を暗示
1/21 14:00
AIでRNAアプタマー創薬を効率化する技術「RaptScore」を開発
1/16 14:00
眼圧を高感度に無線計測するスマートコンタクトレンズを開発
1/14 10:00
データマーケティングを起点とした事業開発の産学連携について
2025/12/25